ビタミンCでヨード液の色が変わる理由?
1999年8月17日に中学3年生の女子からの質問を頂きました。
食物に含まれるビタミンCの量をヨード液を用いて測定する自由研究につき,何故,ヨード液の色が透明になることとビタミンCの量が関係するのでしょうか?(何故色が変化するのでしょうか?)
ビタミンCの量をヨード液で測るというのは重要な実験で、食品や、その他のものに色々な化学物質がどのくらい含まれているかと言う事を定量的に測定する(量を正しく測る)ための基礎となる実験です。
さて、ご質問に有るどうして色が変わるのかという質問ですが、ヨード液はアルコールとかその他の溶媒(色々なものを溶かす事のできる液体)にヨウ素を溶かしたものです。溶かしたものといっても、実は混ざっているだけなのです。ですから、ヨウ素はアルコールなどの溶媒の中ではヨウ素分子というものになっています。
化学式は習ってますか? ヨウ素分子はヨウ素原子二つが共有結合という結びつきをして一つの分子になっています。これを化学式で書くと
I2
となります。このI2は酸化作用が非常に強いのです。酸化作用というのは別の分子(物質)に酸素をくっつけたり、水素を取り除いたりする作用の事です。この酸化作用のおかげで、ヨウ素分子を含んだヨード液は、怪我をした時の消毒薬として使われます。ばい菌を殺しちゃうんですね。オキシドール(過酸化水素水)も同じで、酸化作用が強いので殺菌します。
さて、話を、ヨード液に戻しましょう。ヨード液はこのように酸化作用が強く、しかもヨウ素分子II2の色は紫色です。これが溶けているヨード液も紫色ですね。しかし、このヨード液(ヨウ素)は相手を酸化させると分解してしまうのです。分解して水素とくっついて別の物質、沃化水素になります。沃化水素を化学式で書くと
HI
で、これは無色透明なのです。(この沃化水素はイオン結合という結びつきをしますので、水に良く溶けます)
この話を簡単に書くと
「ヨード液に含まれる紫色のヨウ素I2は酸化作用が強く、別の物質から水素を取り除き無色透明な沃化水素HIという別の物質になります。このとき相手の物質が多ければヨウ素が少なくなり沃化水素が多くなって色は薄くなります。相手の量が少なければヨウ素は多く残りできる沃化水素の量が少ないので色は濃いままです。この沃化水素のできるように比例するので色の変化で相手の量がわかるのです。」
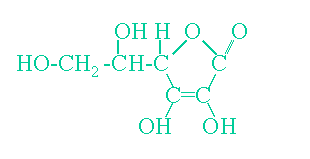
さて、今度はビタミンCの話です。ビタミンCを正しく化学の正式名称で言うと、アスコルビン酸といいます。では、化学式はどうなるでしょう?ちょっと難しいですが書いておきます。こういうもんだと思ってください。

です。今までの話でお分かりのようにビタミンCはこのヨード液の中のヨウ素に酸化されます。しかし、食べ物の中には他にも色々な物質が入っていて、それらもビタミンCと同じように酸化されます。ところが、ビタミンCは還元作用が非常に強いのです。還元作用というのは酸化作用とは逆の反応で、相手から酸素を取ったり、相手に水素を渡したりする性質です。相手が酸化するというのは自分が還元する事で、相手を還元するということは自分が酸化する事です。従って、酸化作用と還元作用が強いもの同士は反応しやすいのです。そこで、食物の中ではビタミンCとヨード液が反応するのです。
さて、まとめましょう。
「ヨード液に含まれる紫色のヨウ素がビタミンC(アスコルビン酸)と反応(酸化還元反応)して、無色透明の沃化水素に変わるために色が変わります。」
化学式で書くと
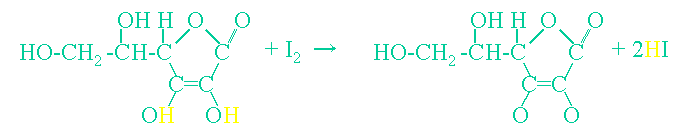
アスコルビン酸分子とヨウ素分子が反応してディハイドロアスコルビン酸分子(水素の無いアスコルビン酸という意味です)と2
個の沃化水素ができます。上の化学式でわかるようにアスコルビン酸の水素が二つ取れて、ヨウ素とくっついて沃化水素になっています。
自由研究として、食べ物の重さとビタミンCの量を次ぎのように測定すると良いですね。例えば、食べ物10gを刻んで細かくし、20mlの水の中ですりつぶします。そして、それをガーゼなどでしぼって水溶液を作ります。別のコップなどにヨード液を5mlとって、先ほどの食物の水溶液をスポイトなどで1滴ずつ加えていって、透明になるまでの滴数を数えます。これで、どの食べ物にビタミンCが多く含まれているか判りますね。